
Poznaj fascynujący świat degradacji białek
dzięki naszej grze komputerowej
Zapraszamy do zabawy w odkrywanie mechanizmów degradacji białek w naszej edukacyjnej grze komputerowej i poznania systemu ubikwityna-proteasom, który eliminuje nieprawidłowe białka w naszych komórkach. Odkryj razem z nami również terapie wykorzystujące celowaną degradację białek – innowacyjną metodę niszczenia patogenicznych białek przy użyciu naszych własnych szlaków degradacji komórkowej.
Dołącz do nas już teraz, aby uczyć się, bawić i odkrywać sekrety życia komórkowego!
Degradacja białek
Odkryj mechanizmy odpowiedzialne za niszczenie białek i ich znaczenie dla funkcjonowania komórek i rozwoju nowych terapii
Sztuka utrzymywania równowagi
Białka są cząsteczkami odpowiedzialnymi za wykonywanie wielu niezbędnych funkcji w komórce. Ich tworzenie rozpoczyna się od przepisania DNA na mRNA (ang. messenger RNA; matrycowy RNA) w procesie nazywanym „transkrypcją”. Tak powstała cząsteczka mRNA służy jako szablon do syntezy białek, czyli procesu translacji, który odbywa się przy udziale rybosomów. Podczas translacji aminokwasy łączą się i tworzą łańcuch polipeptydowy, który formuje się w funkcjonalną strukturę białka. Ludzka komórka może wytwarzać do ok. 20 000 różnych białek.
Utrzymanie homeostazy (równowagi) białek wymaga skutecznych mechanizmów ich degradacji. Każde białko trwa określony czas w komórce – kilka minut lub nawet lata. Białka mogą się jednak niepoprawnie uformować lub zawierać niewłaściwe aminokwasy co sprawia, że ich terminowe i prawidłowe usunięcie ma podstawowe znaczenie dla właściwego funkcjonowania komórek. Głównym szlakiem odpowiedzialnym za degradację białek jest system ubikwityna-proteasom.

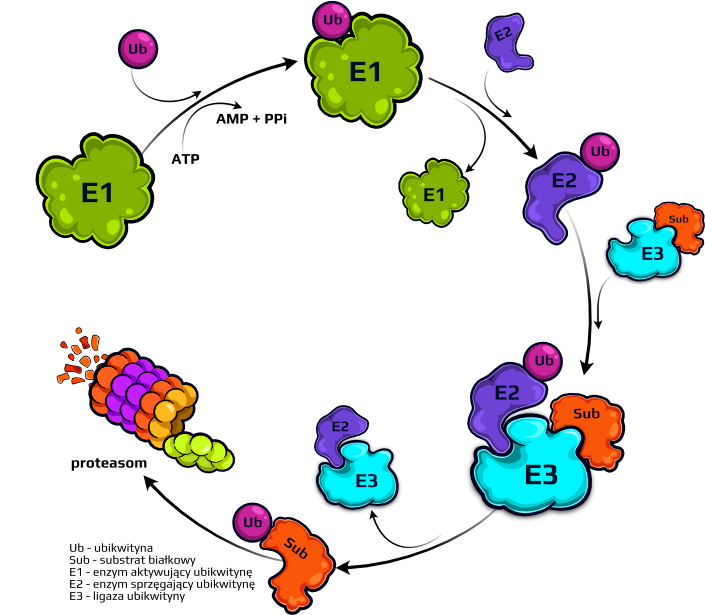
System ubikwityna-proteasom

W naszej grze pokazujemy funkcjonowanie systemu ubikwityna-proteasom (UPS). Obejmuje on kaskadę enzymów, w skład której wchodzą: E1 – enzym aktywujący ubikwitynę; E2 – enzym sprzęgający ubikwitynę i E3 – ligazę ubikwityny, które współpracują ze sobą w celu przyłączenia ubikwityny do białka docelowego. Proces ten, nazwany „ubikwitynacją”, powoduje, że białka są rozpoznawane, a następnie degradowane przez proteasom. Proteasom działa jak komórkowe centrum recyklingu, rozbijając białka znakowane ubikwityną na krótkie łańcuchy aminokwasowe, które mogą być ponownie wykorzystane przez komórkę, np. do syntezy nowych białek
UPS odgrywa ważną rolę w utrzymaniu homeostazy białek przez kontrolę ich poziomu i eliminację niepożądanych przez komórkę białek. W ten sposób reguluje różne procesy molekularne, jak: cykl komórkowy, przekazywanie sygnałów, naprawa DNA. Mutacje składowych UPS mogą prowadzić do nagromadzenia białek, zaburzyć funkcje komórkowe i przyczynić się do rozwoju różnych chorób, w tym: raka, choroby Alzheimera i choroby Parkinsona.
Ukierunkowana degradacja białek - przyszłość medycyny?
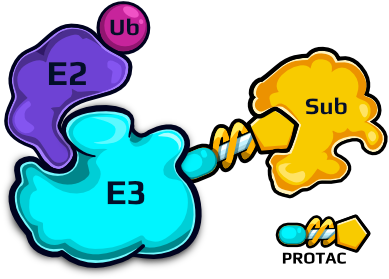
Co by było, gdybyśmy mogli wykorzystać nasz własny system ubikwityna-proteasom i dostosować go do usunięcia „toksycznych„ białek wywołujących chorobę? Cóż, nie jest to już science fiction – tak działają nowoczesne terapie celowanej degradacji białek (ang. targeted protein degradation). Strategia jest prosta: naukowcy projektują związki pozwalające ligazom E3 na wiązanie białek, które nie są przez nie standardowo rozpoznawane. Następnie ligazy E3 doprowadzają je do enzymów E2, co skutkuje ubikwitynacją białek i degradacją przez proteasom. Dwie główne klasy związków, wykorzystujących mechanizmy celowanej degradacji białek, to: kleje molekularne i PROTAC (ang. PROteolysis TArgeting Chimeras). Kleje molekularne są małymi cząsteczkami wzmacniającymi interakcje między ligazą E3 a wybranym białkiem; PROTAC natomiast składa się z dwóch części: jedna rozpoznaje określoną ligazę E3, a druga – wybrane białko.
Kleje molekularne, na przykład: lenalidomid lub pomalidomid, odniosły już sukces kliniczny – są stosowane w leczeniu nowotworów, takich jak szpiczak mnogi. Natomiast kilkanaście związków PROTAC jest obecnie przedmiotem zaawansowanych badań klinicznych, m.in. przeciw rakom piersi czy prostaty. Celowana degradacja białek oferuje możliwość niszczenia białek powodujących choroby, w tym białek onkogennych, i niesie nadzieję na zastosowanie w terapii wielu chorób.

Postacie z gry
Poznaj niesamowite postacie z gry!
Ligaza ubikwityny E3

Główny bohater gry. Ma za zadanie rozpoznawać inne białka (substraty) i pośredniczyć w ich ubikwitynacji, co prowadzi do ich zniszczenia.
Enzym sprzęgający ubikwitynę E2

Najlepszy towarzysz ligazy ubikwityny E3. Tworzy z nią kompleks i przenosi ubikwitynę na substraty.
Substraty

Różne białka, ale jeden cel: oznaczyć je ubikwityną i wysłać do degradacji.
Ubikwityna

Szara eminencja gry. Jej przyłączenie do docelowego białka działa jako sygnał "zniszcz mnie" dla proteasomu.
Proteasom

Duży kompleks molekularny, który funkcjonuje jako komórkowe centrum recyklingu. Rozpoznaje i niszczy ubikwitynowane białka.
Enzym deubikwitynujący

Główny antagonista. Usuwa ubikwitynę z białek, zapobiegając tym samym ich degradacji.
Ze specjalnym udziałem...
PROTAC (PROteolysis TArgeting Chimera)
Dla edukatorów
Nasza gra została stworzona z myślą o edukacji, ponieważ wierzymy, że nie ma lepszego sposobu na naukę niż zabawa. Aby urozmaicić podróż do fascynującego świata degradacji białek, przygotowaliśmy szereg materiałów do pobrania, które uzupełnią wiedzę zdobytą w naszej grze.
Konspekt lekcji (wiek 15+)
Konpekt lekcji biologii dla szkół ponadpodstawowych.
Konspekt lekcji (wiek 12-15)
Konspekt lekcji biologii dla klas 7 i 8 szkół podstawowych.
Prezentacja
Edytowalna prezentacja multimedialna w formacie PowerPoint do wykorzystania na lekcji biologii.
Autorzy

NATALIA
SZULC

ANNA
OLCHOWIK

PATRYCJA JASZCZAK

BARTOSZ JANIAK

WOJCIECH POKRZYWA
Publikacja
Podziękowania
Komputerowa gra edukacyjna dofinansowana ze środków budżetu państwa w ramach programu Ministra Edukacji i Nauki pod nazwą Społeczna Odpowiedzialność Nauki nr projektu SONP/SP/546507/2022; kwota dofinansowania 101 706 PLN; całkowita wartość projektu 115 756 PLN.


Partnerzy gry



